فیزیکدانی دانمارکی به نام «نیلز بور» (Niels Bohr) در سال ۱۹۱۳ مدلی از اتم را ارائه داد که تحت عنوان مدل اتمی بور شناخته میشود. در حقیقت او مدل اتمی رادرفورد را اصلاح کرد. پیشتر رادرفورد بیان کرده بود که اتم از هستهای با بار مثبت تشکیل شده که بارهای منفی یا همان الکترونها اطراف آن قرار دارند. نیلز بور با رفع کردن محدودیتهای توصیف رادرفورد از اتم، تصویری از اتم ارائه داد که امروزه در ذهن ما است.
تشریح نظریه نیلز بور
طبق مدل اتمی بور، الکترونها در مسیرهای ثابتی اطراف هسته، تحت عنوان اوربیتال (Orbital) در حال حرکت هستند. در مطلبی جداگانه مفهوم اوربیتال را توضیح خواهیم داد. مبتنی بر این مدل، هستهای با بار الکتریکی مثبت در مرکز قرار گرفته و الکترونهای با بار منفی در سطوح انرژی ثابتی اطراف آن در حال گردش هستند. این نظریه همچنین بیان میکند که الکترونهای قرار گرفته در فاصلهای دورتر از هسته دارای انرژی بیشتری هستند. در حالی است که الکترونهای نزدیکتر به هسته از انرژی کمتری برخوردارند. مطابق شکل زیر شماتیک مدل اتمی بور ترسیم شده است.

مدل اتمی بور
فرضیات مدل اتمی بور
- الکترون در اتم هیدروژن در مسیری دایره ای شکل به دور هسته گردش میکند.
- انرژی این الکترون با فاصلۀ آن از هسته رابطه ای مستقیم دارد. در واقع هر چه الکترون از هسته دورتر می شود، انرژی آن افزایش می یابد.
- این الکترون فقط می تواند در فاصله های معین و ثابتی پیرامون هسته گردش کند. در واقع الکترون فقط اجازه دارد که مقادیر معینی انرژی داشته باشد. به هر یک از این مقادیر انرژی تراز انرژی می گویند.
- این الکترون معمولا در پایین ترین تراز انرژی ممکن (نزدیکترین مدار به هسته) قرار دارد. به این تراز انرژی حالت پایه می گویند.
- با دادن مقدار معینی انرژی به این الکترون می توان آن را قادر ساخت که از حالت پایه (ترازی با انرژی کمتر) به حالت برانگیخته (ترازی با انرژی بالاتر) انتقال پیدا کند.
- الکترون درحالت برانگیخته ناپایدار است، از اینرو همان مقدار انرژی را که پیش از این گرفته بود از دست می دهد و به حالت پایه باز می گردد. از آنجا که برای الکترون نشر نور مناسب ترین شیوه برای از دست دادن انرژی است، از اینرو الکترون برانگیخته به هنگام بازگشت به حالت پایه انرژی اضافی خود را که در واقع تفاوت انرژی میان دو تراز انرژی یاد شده است، از طریق انتشار نوری با طول موج معین ازدست می دهد.
نتایج مدل اتمی بور
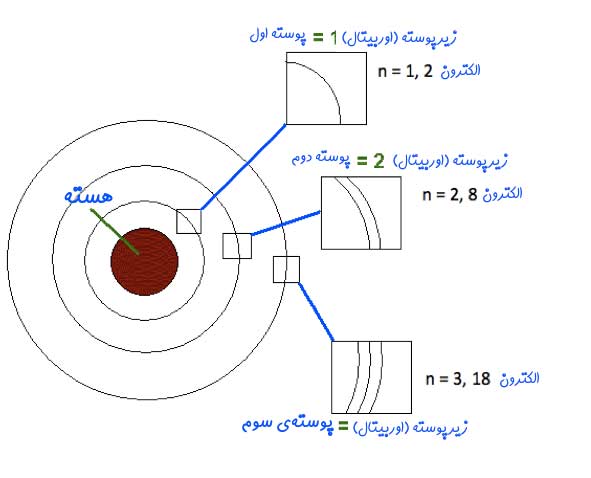
- الکترونها در مسیرهای دایرهای ثابتی در اطراف هسته در حال حرکتاند. این مسیرها تحت عنوان اوربیتال شناخته میشوند.
- انرژی الکترونها در این مسیرها، مقداری ثابت است. چندین اوربیتال یک «پوسته» (Shell) را تشکیل میدهند. در شکل زیر اوربیتال، پوسته و دیگر اجزای اتم نشان داده شدهاند. تا زمانی که الکترون در مسیر ثابت خودش گردش کند، انرژیای تابش نخواهد کرد.
- سطوح انرژی متفاوت با اعداد n نشان داده میشوند. در حقیقت n=1، پوسته اول، n=2 پوستهی دوم و به همین شکل پوستهها -یا همان سطوح انرژی- با این اعداد نشان داده میشوند. به این مقادیر اعداد کوانتومی گفته میشود. این عدد از کمترین سطح (n=1) شروع شده و تا مقادیر صحیح بالاتر ادامه پیدا میکند.
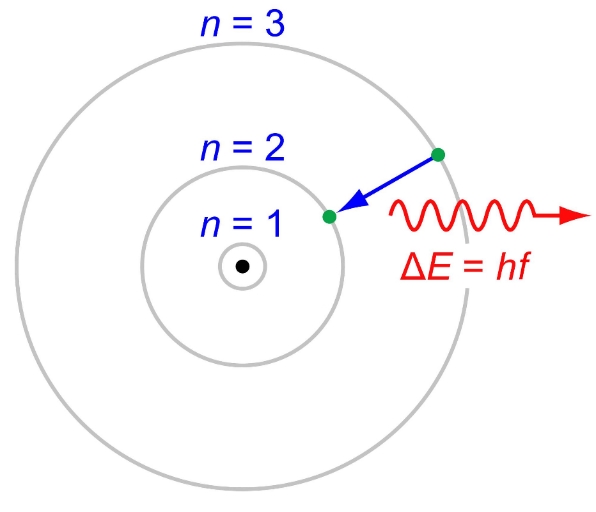
- تغییرات انرژیِ یک الکترون زمانی رخ میدهد که سطح انرژیش تغیر کند. در یک اتم الکترون با گرفتن انرژی از n کم به n بیشتر منتقل میشود. از طرفی وقتی الکترونی انرژیش را از دست بدهد، سطح انرژی آن نیز کاهش مییابد. تغییرات انرژی الکترون در شکل زیر نشان داده شده است. در این شکل الکترون از لایهی سوم به سطح انرژی پایینتر در لایه دوم رفته و در نتیجه آن انرژی گسیل داده است. در مطلبی تحت عنوان اثر فوتوالکتریک در مورد مقدار و نحوه انرژی گسیل داده شده بحث شده است.
توزیع الکترونها در پوستهها و اوربیتالها
ماکسیمم ظرفیت لایهی nام برای نگه داشتن الکترون در خود را میتوان با استفاده از فرمول 2n2 محاسبه کرد. برای نمونه بیشترین تعدادی از الکترون که میتواند در لایهی شماره ۱ قرار گیرد برابر با ۲=۱۲×۲ است.
مبتنی بر فرمول ۲n2 بیشترین تعدادی از الکترون که میتواند در پوسته شماره ۲ قرار گیرد نیز برابر با ۸=۲۲×۲ است.
معرفی ساختار اتم
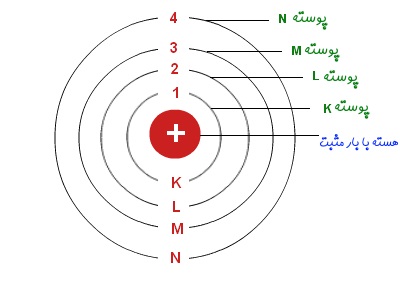
در شکل روبرو پوستههای مذکور به همراه ظرفیت آنها نشان داده شده است.
- در ساختار اتم در پوسته اول (سطح انرژی اول) که با نماد K نشان داده میشود، میتواند حداکثر ۲ الکترون را در خود نگه دارد.
- پوسته دوم (سطح انرژی دوم) با نماد L نشان داده شده و در بیشترین حالت میتواند ۸ الکترون را در خود نگه دارد.
- پوسته سوم که با نماد M نشان داده میشود میتواند ماکزیمم ۱۸ الکترون را در خود جا دهد.
- جهت نشان دادن پوسته چهارم از نماد N استفاده شده و میتواند در بهترین حالت ۳۲ الکترون را در خود نگه دارد.
- به همین صورت با افزایش شماره پوسته، تعداد الکترونهای قرار گرفته در لایهها نیز افزایش مییابد.
محدودیتهای مدل اتمی بور
مدل اتمی بور دارای محدودیتهایی است که در زیر مهمترین این محدودیتها ذکر شدهاند:
- این مدل قادر به توجیه «اثر زیمان» (Zeeman Effect) نیست (اثر زیمان تاثیر میدان مغناطیسی بر طیف اتمی عناطر را بیان میکند).
- این مدل اصل عدم قطعیت هایزنبرگ را نقض میکند.
- مدل اتمی بور نمیتواند طیف اتمهای بزرگتر را توضیح دهد.
در پایان با تماشای این ویدئوی آموزشی به شما مدل اتمی بور را نشان خواهیم داد. بعد از تماشای این ویدئو هرگونه سوال و مطلبی برای بیان دارید در پایین پیج بنویسید تا در اسرع وقت به سوال شما پاسخ داده شود.




