اسید (Acid) و باز (Base) عباراتی نسبی هستند و در حقیقت، یک مولکول را بدون در نظر گرفتن سایر شرایط، نمیتوان یک اسید نامید. به طور مثال، هیدروژن کلرید گازی HCl(g)HCl(g) مولکول بسیار پایداری است که تا وقتی به سیستمی شامل آن، ذرهای اضافه نشود، هیچ رفتار اسیدی یا بازی از خود نشان نمیدهد. اگر آب را به سیستم اضافه کنیم، HCl به سادگی با آب وارد واکنش میشود و یونهای H3O+H3O+ و Cl−Cl− را تولید میکند. در این مطلب قصد داریم تا به بررسی اسیدها و بازها و تعاریف، نظریهها و مباحث مربوط به آنها بپردازیم.
تعریف اسید (Acid)
در تعاریف مرتبط با اسید و باز، اسید به آن دسته از مولکول ها یا یون ها گفته می شود که می توانند یک پروتون از دست بدهند یا به عبارت دیگر توانایی تشکیل پیوند کووالانسی با یک جفت الکترون را دارند. جالب است بدانید که این مواد را بر اساس نام ترکیب غیرفلزی آن ها نام گذاری می کنند. حال در ادامه به برخی از خواص مهم این مواد می پردازیم:
- در محلول آبی پروتون آزاد می کنند.
- ترش مزه هستند.
- کاغذ شناساگر را قرمز می کنند.
- pH کمتر از 7 دارند.
تعریف باز (Base) یا قلیا
حال که با مفهوم اسید آشنا شدیم، لازم است برای شناخت اسید و باز، به بررسی مفهوم، خواص و انواع بازها نیز بپردازیم. در تعریف شیمیایی، باز به موادی گفته می شوند که در آب یون های هیدروکسید آزاد می کنند. به عبارتی، موادی باز نام دارند که هنگام حلالیت در آب، pH محلول را به بیشتر از 7 افزایش دهند. در ادامه به برخی خواص کلیدی بازها اشاره می کنیم:
- بازها عموما لغزنده هستند.
- مزه تلخی دارند.
- در صورت واکنش با اسیدها نمک تولید می کنند.
- خورنده هستند.
- محلول های آبی بازها رسانای الکتریکی هستند.
- کاغذ شناساگر را آبی می کنند.
- دارای pH بیشتر از 7 هستند.
بررسی تئوری های اسید و باز در معادلات شیمی
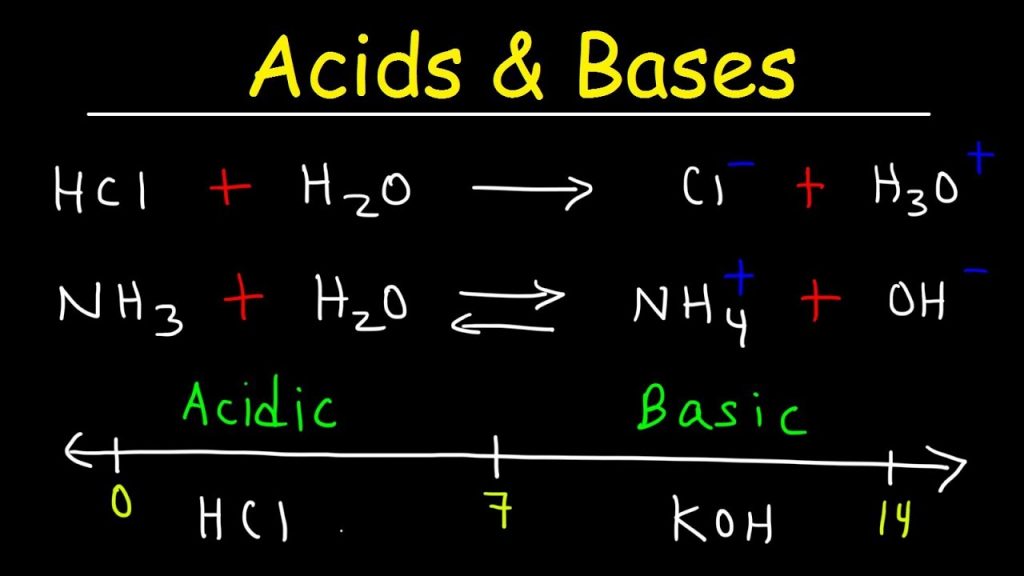
مهمترین تئوری اسید و باز چهار دسته اند :
- تئوری آرنیوس
- تئوری برونشتد و لوری
- تئوری لوئیس
- تئوری اسید و باز سیستم حلال
تعدد تعاریف در مورد این تئوری ها مختلف است. اهمیت آنها در تجزیه و تحلیل هنگام واکنشهای اسید و باز در حالتهای گازی یا به خصوص مایع مشخص میشود. چهار دستهبندی کلی برای اسیدها و بازها در نظر گرفته میشود. تعریف آرنیوس از اسید بیان میکند که اسیدها در محلول H+H+ تولید میکنند و در بازها نیز یون OH−OH− به تولید میرسد. بعد از توسعه این نظریه در سال ۱۸۸۳ توسط آرنیوس، دو نظریه عمومی دیگر در مورد اسیدها و بازها نیز معرفی شدند. این نظریهها، نظریه «برونشتد-لوری» (Brønsted-Lowry) و لوییس بودند.
در این متن، ابتدا تئوری آرنیوس و برونشتد لوری را بررسی میکنیم و سپس به طور مجزا به بررسی مفهوم اسید و باز برونشتد و لوری میپردازیم.
در جلسه آینده در مورد نظریهٔ لوری-برونشتد صحبت خواهیم کرد. که بر طبق این تئوری اسید ماده ای است که پروتون (H+) از دست میدهد و باز ماده ای است که پروتون میگیرد. به عنوان نمونه در واکنش اسید استیک و آب، استیک اسید پروتون از دست داده و آب پروتون میگیرد. پس استیک اسید، اسید و آب به عنوان باز عمل میکند.
در این ویدیوی آموزشی که به جهت آموزش آنلاین شیمی نظری برگزار شده است ما به بررسی در مورد انواع تئوری ها اشاره خواهیم کرد. این تئوری در سال 1923 نوشته شده است.
در پایان این ویدئو هر کدام از دانشجویان عزیز اگر در مورد این بحث سوال و موردی برای بیان دارند میتوانند در پایین پیج بصورت مکتوب سوالات و پیشنهادات خود را بنویسند در اسرع وقت به سوالات شما پاسخ داده خواهد شد.
امید است استفاده کافی را از این ویدئو ببرید.





سلام استاد ، برای ترم یک داروسازی فقط جلد ۲ مورتیمر لازمه ؟
هر دو جلد را تدریس می کنم
سلام استاد رجبی بنده دانشگاهی نیستم و دارم کتاب شیمی عمومی یک رو با شیمی ۱ راهنمایی مطالعه میکنم هدفم برای شیمی فیزیک هست ، این کتاب رو شروع به خواندن کردم از الان عیبی ندارد ؟