از اتصال دو نیم سلول به یکدیگر یک سلول الکتروشیمیایی به وجود می آید که شارش الکترون بین آن ها باعث به وجود آمدن اختلاف پتانسیل الکتروشیمیایی (Electrochemical potential) می شود. در اینجا چگونگی اندازه گیری پتانسیل دو عنصر مس و روی را خواهیم دید.
در یک سلول گالوانی، زمانیکه الکترونها در خارج از سلول بوسیله سیم الکتریکی مدار، از آند به کاتد جریان پیدا میکنند، این جریان به دلیل اختلاف در انرژی پتانسیل بین دو الکترود در سلول الکتروشیمیایی بوجود میآید. نیروی الکتروموتوری استاندارد (emf) بیشترین ولتاژی است که یک سلول الکتروشیمیایی می تواند به وجود بیاورد. اختلاف پتانسیل الکتروشیمیایی الکترودی استاندارد دو نیم سلول یک سلول الکتروشیمیایی است که با سلول E° نمایش داده می شود.
سلول الکتروشیمیایی
سلول پتانسیل که آن را با Ecell نشان میدهند، معیاری برای اندازهگیری اختلاف پتانسیل بین دو نیمسلول در یک سلول الکتروشیمیایی است. این اختلاف پتانسیل به دلیل جریان الکترونها از یک نیمسلول به دیگری اتفاق میافتد. علت چنین جریانی از الکترونها، وجود واکنشهای شیمیایی از نوع ردوکس ذکر میشود. یک واکنش اکسایش-کاهش (ردوکس) زمانی اتفاق میافتد که در طول واکنش، یک ماده اکسید شود و دیگری کاهش پیدا کند. در طول اکسیداسیون، ماده مورد نظر، یک یا چند الکترون از دست میدهد. در مقابل، به هنگام واکنش کاهش، ماده مورد نظر، با گرفتن الکترون، باردار میشود.
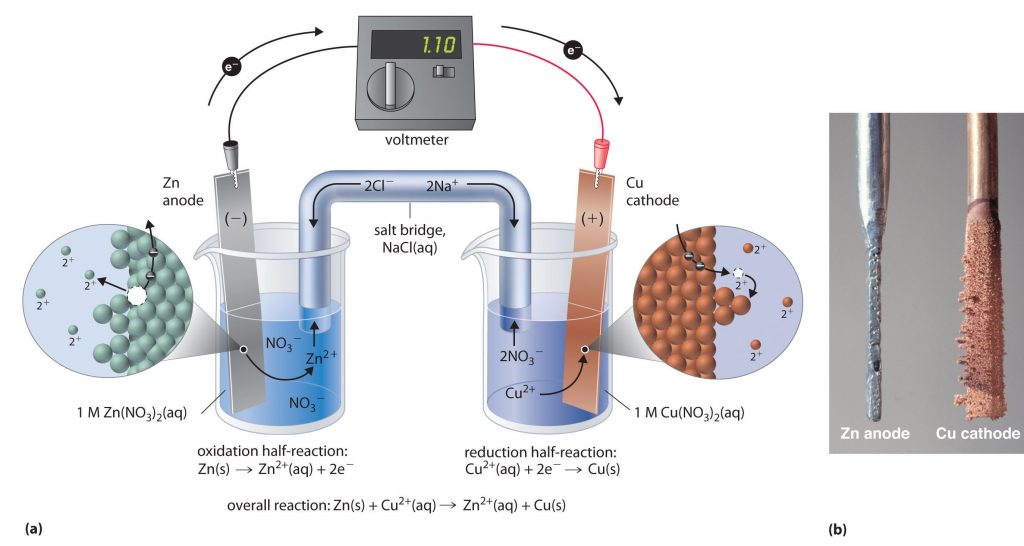
دریافتید که فلزها قدرت کاهندگی متفاوتی دارند. در اینجا به چگونگی انجام پتانسیل شیمیایی می پردازیم. برای نمونه، روی، کاهنده تر از مس است. دستگاهی که بر اساس قدرت کاهندگی فلزها، انرژی الکتریکی تولید می کند، نوعی سلول الکتروشیمیایی است. فرض کنید که یک تیغه از جنس فلز روی درون یک بشر دارای محلول آبی یونهای روی (مانند محلول روی سولفات) قرار دارد. به این مجموعه یک نیم سلول می گویند. در این نیم سلول برای برقراری تعادل، تعدادی از اتمهای Zn ، الکترونهای خود را روی سطح تیغۀ روی (رسانای الکترونی که به آن الکترود گفته می شود) می گذارند و به صورت یونهای +Zn2 وارد محلول می شوند. در نتیجه بین تیغۀ روی (الکترود) و محلول (الکترولیت)، اختلاف پتانسیلی به وجود می آید. پتانسیل الکترودی نامی است که بر این اختلاف پتانسیل نهاده اند.
تعادل مشابهی در این پتانسیل الکتروشیمیایی نیز با قراردادن یک تیغه از جنس فلز مس درون محلول آبی دارای یونهای مس(II)برقرار می شود. به این ترتیب با تشکیل نیم سلول مس، پتانسیل الکترودی ویژه ای نیز به وجود می آید. اگر این دو نیم سلول به هم متصل شوند، مجموعه ای به دست می آید که نوعی سلول الکتروشیمیایی را نشان می دهد. در این سلول الکتروشیمیایی همان واکنش جانشینی ساده ای رخ می دهد که با واردکردن تیغه ای از جنس فلز روی در محلول آبی دارای یونهای مس (II)به وقوع می پیوست. با این تفاوت که در این حالت، واکنش در شرایطی کنترل شده انجام می گیرد.
پتانسیل استاندارد سلول
پتانسیل استاندارد سلول به صورت پتانسیل یک سلول تحت شرایط استاندارد تعریف میشود. این بدان معنی است که تمامی ذرات در حالت استاندارد خود هستند. بنابراین، توجه داشته باشید که پتانسیل اکسایش کاهش به انرژی پتانسیل الکترونهای لایه ظرفیت، غلظت ذرات در واکنش و دمای سیستم وابسته است.




